Nueva información sobre mutaciones proteicas que causan el síndrome de Rett

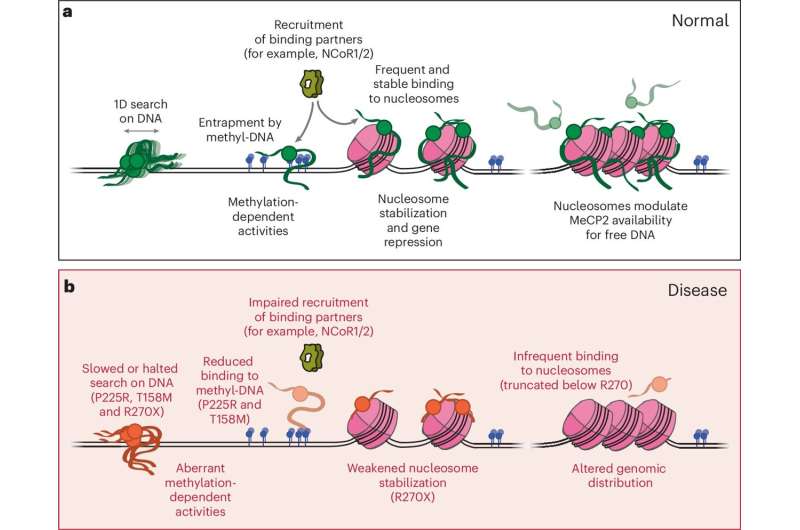
Modelo de trabajo para la función normal de MeCP2 en la cromatina y su desregulación en la enfermedad. Crédito: Naturaleza Biología estructural y molecular (2024). DOI: 10.1038/s41594-024-01373-9
Una proteína en particular está en el centro del desarrollo del cerebro. Un regulador maestro de la expresión genética, está abundantemente presente en las neuronas, y su disfunción es la base del síndrome de Rett, un trastorno neurológico que puede provocar graves deterioros cognitivos, motores y de comunicación en las niñas.
Sin embargo, los científicos entienden poco acerca de cómo esta proteína esencial realiza su trabajo crucial a nivel molecular. «La gente ha estado estudiando esta proteína durante décadas sin un consenso claro sobre qué hace, dónde se une al genoma y cuáles son sus funciones», dice Shixin Liu de Rockefeller. Ahora, un nuevo estudio del laboratorio de Liu arroja luz sobre cómo la proteína MeCP2 interactúa con el ADN y la cromatina.
Los descubrimientos, publicado en Naturaleza Biología estructural y molecularproporcionar información sobre este regulador maestro y puede abrir nuevas vías para terapias para el síndrome de Rett.
Un enfoque de una sola molécula
MeCP2 es una proteína confusa. Aunque se ha implicado en la regulación de miles de genes y se considera fundamental para el desarrollo neurológico, sus impactos en el genoma son difíciles de definir. Cantidades insuficientes de MeCP2 de tipo salvaje causan el síndrome de Rett, pero demasiada proteína causa un trastorno neurológico debilitante similar conocido como síndrome de duplicación de MeCP2.
Liu y sus colegas aprovecharon el área de especialización del laboratorio (observación y manipulación de moléculas individuales) para comprender mejor cómo interactúa MeCP2 con el ADN. El equipo unió una sola pieza de ADN entre perlas de plástico del tamaño de un micrómetro, cada una sostenida por un láser, y luego incubó el ADN con proteínas MeCP2 marcadas con fluorescencia. Esta configuración les permitió seguir de cerca el comportamiento dinámico de la misteriosa proteína.
Se cree que MeCP2 realiza sus funciones exclusivamente en ADN modificado con citosinas metiladas, pero no existe una explicación satisfactoria para tal especificidad, ya que la proteína se une fácilmente al ADN metilado y no metilado.
El equipo descubrió que MeCP2 se mueve dinámicamente en el ADN, pero de manera mucho más lenta en la forma metilada en comparación con la no metilada. Además, demostraron que estas diferentes dinámicas permiten que MeCP2 reclute de manera más eficiente otras proteínas reguladoras en sitios de ADN metilados, lo que puede ayudar a dirigir las funciones reguladoras del gen MeCP2 a ubicaciones específicas dentro del genoma.
«Descubrimos que MeCP2 se desliza más rápido a través del ADN no metilado, y esta diferencia en el movimiento puede explicar cómo la proteína los diferencia», dice Gabriella Chua, investigadora graduada en el laboratorio de Liu y primera autora del artículo.
«Esto es algo que sólo podríamos haber descubierto utilizando una técnica de una sola molécula».
Liu y Chua también descubrieron que la proteína muestra una preferencia muy fuerte por unirse a los nucleosomas, carretes de proteína que están envueltos con nuestro material genético, en lugar de ADN puro. Esta interacción estabiliza los nucleosomas de una manera que puede suprimir la transcripción genética, lo que sugiere cómo el propio MeCP2 regula la expresión genética.
Nuevas ideas sobre los nucleosomas
La observación de que un regulador maestro de la expresión genética interactúa con mayor frecuencia con esta forma compacta de ADN ayuda a reforzar la noción cada vez mayor de que los nucleosomas son mucho más que «carretes de almacenamiento» inertes de ADN, y que los científicos deben empezar a pensar más en la función de MeCP2. en el contexto de los nucleosomas.
«Nuestros datos son uno de los ejemplos más definitivos de este fenómeno hasta la fecha», afirma Liu. «Está claro que MeCP2 prefiere unirse a los nucleosomas».
De esta manera, MeCP2 funciona como una proteína de unión a cromatina, en contraste con la visión convencional que la ve principalmente como una proteína de unión a metil-ADN. En este estudio, el equipo también se centró en la parte de la proteína responsable de su actividad de unión a nucleosomas.
«El ADN puro es una minoría: los nucleosomas están muy extendidos en nuestros genomas», dice Chua. «Varios estudios recientes han demostrado que los nucleosomas no son simplemente barreras pasivas para la transcripción, sino puntos activos para la regulación genética».
Un ejemplo particularmente notable de esta funcionalidad del nucleosoma es cómo interactúa MeCP2 con él.
En trabajos futuros, el equipo planea expandirse más allá del presente estudio in vitro para examinar MeCP2 in vivo, donde se espera que las interacciones entre la proteína y el nucleosoma sean más complejas. También planean utilizar las técnicas descritas en este artículo para estudiar mejor las numerosas mutaciones de MeCP2 que causan enfermedades como el síndrome de Rett.
La esperanza es que una comprensión más completa de la proteína central de esta devastadora enfermedad algún día pueda conducir a terapias.
«No existe cura para Rett, pero la comunidad de investigadores que lo estudian está decidida y llena de energía. Muchos encontraron nuestros datos intrigantes cuando los compartimos con ellos», dice Chua. «Nuestros hallazgos resaltan cómo la investigación básica puede ayudar a la comunidad clínica a comprender mejor una enfermedad».
Más información:
Gabriella NL Chua et al, La dinámica diferencial especifica la función de MeCP2 en nucleosomas y ADN metilado, Naturaleza Biología estructural y molecular (2024). DOI: 10.1038/s41594-024-01373-9
Cita: Nuevos conocimientos sobre las mutaciones proteicas que causan el síndrome de Rett (26 de agosto de 2024) obtenido el 26 de agosto de 2024 de https://medicalxpress.com/news/2024-08-insight-protein-mutations-rett-syndrome.html
Este documento está sujeto a derechos de autor. Aparte de cualquier uso legítimo para estudios privados o fines de investigación, ninguna parte puede reproducirse sin permiso por escrito. El contenido se proporciona únicamente con fines informativos.





