Biólogos computacionales diseñan una nueva y mejorada proteína de barril de triosafosfato isomerasa

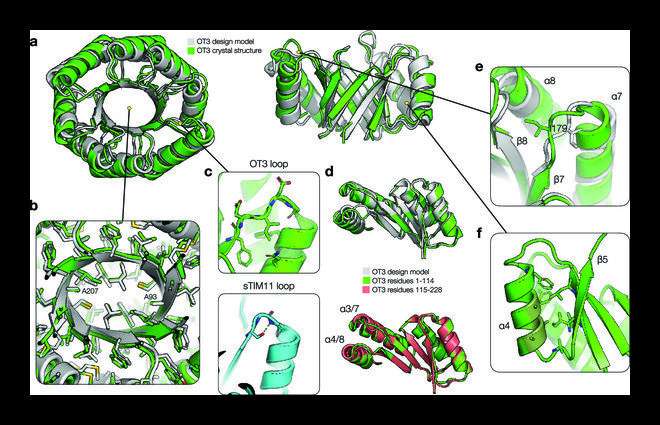
Estructura cristalina de OT3. ( a ) Comparación del modelo de diseño OT3 (gris) y la estructura cristalina de rayos X (verde). La vista superior se muestra a la izquierda y la vista lateral con las hélices 1-3 recortadas se muestra a la derecha. (b) Vista en corte del empaquetamiento de la cadena lateral en el núcleo hidrofóbico, con los átomos pesados de la cadena lateral mostrados como varillas. (c) Superiora: βα el bucle 3 se muestra con cadenas laterales y átomos de la columna vertebral y algunas cadenas laterales circundantes. Abajo: La estructura de bucle de sTIM11 se muestra con el hidrógeno Ser frente al núcleo unido a un átomo de estructura de bucle. (d) Arriba: Alineación de la primera mitad de la estructura OT3 con la primera mitad del modelo de diseño. Abajo: Alineación de la primera mitad del marco OT3 con la segunda mitad del marco OT3. (y) βα bucle 7 mostrado con empaque Ile179 en una conformación diferente en comparación con el modelo de diseño. ( f ) Un ejemplo de residuos de Ala helicoidales que forman interacciones de grupos hidrofóbicos menos ideales y una falta de anclaje estructural fuerte de «perillas en los agujeros». residuos de ala en α4 (verde oscuro) y se muestran las cadenas laterales cercanas. Crédito: Investigación en biodiseño (2022). DOI: 10.34133/2022/9842315
Las proteínas y enzimas realizan varias funciones importantes dentro del cuerpo humano. Para diseñar una proteína funcional, es importante poder controlar la estructura de los pliegues de la proteína y comprender la relación entre la secuencia, la estructura y la estabilidad de la proteína. Los desarrollos recientes en biología computacional han permitido el diseño de novo de proteínas con estructuras y pliegues variados.
Una de esas estructuras es el pliegue de proteína de barril de triosafosfato isomerasa (TIM), que ocurre en casi el 10% de todas las enzimas y está involucrada en el metabolismo mediado por proteínas. Tiene una estructura simple con subunidades beta/alfa repetidas que están conectadas por bucles variables y, por lo tanto, se usa ampliamente como andamio para diseñar otras proteínas. Sin embargo, no se ha explotado por completo para diseñar proteínas funcionales, debido a los desafíos para alterar su arquitectura general.
Recientemente, un equipo de investigadores dirigido por el Dr. Po-Ssu Huang, de la Universidad de Stanford, llevó a cabo un estudio para investigar si la estructura del barril beta central podría cambiarse nuevamente, eliminando los bucles estructurales y mejorando su estabilidad. Su objetivo era diseñar una proteína de barril TIM con alta estabilidad y propiedades funcionales, y sus hallazgos se publicaron en Investigación en biodiseño🇧🇷
«Aunque una proteína de barril TIM se había diseñado de novo anteriormente, era difícil alterar con precisión la curvatura de su barril beta central, lo que limitaba su utilidad para el diseño funcional», dijo el Dr. Huang al hablar de los intentos anteriores de crear una proteína funcional utilizando el plegamiento de barril TIM.
En primer lugar, el equipo utilizó el marco RosettaRemodel (24) para generar e identificar estructuras proteicas óptimas mediante un enfoque autorregresivo. Luego utilizaron un protocolo de diseño de secuencias iterativas para generar múltiples secuencias con una alta proporción de diseños de plegado exitosos.
Junto con síntesis de proteínas y determinación de la estructura, una proteína de barril TIM recientemente desarrollada con doble simetría (ovoide) y una sintaxis completamente nueva, es decir, información topológica y una nueva secuencia. La estructura cristalina de esta proteína se parecía mucho al modelo de diseño creado por el equipo, lo que confirma su hipótesis de diseño.
Con respecto a las propiedades estructurales de la proteína barril TIM, el Dr. Huang dice: «La proteína diseñada exhibió una arquitectura de barril β alargada con bucles que no estaban estructuralmente involucrados y un núcleo hidrofóbico más desarrollado».
El equipo descubrió además que las cuerdas diseñadas eran muy estables y podían doblarse a la curvatura del barril diseñada. Además, la forma ovalada del barril TIM demostró ser adecuada para incorporar diferentes identidades y combinaciones de residuos.
Además, el equipo empleó la mutagénesis, un proceso en el que los principales residuos de aminoácidos que componen una proteína se reemplazan por aminoácidos con propiedades similares o contrastantes. Sorprendentemente, a pesar de la modificación, el cañón TIM resultante proteína mostró una alta estabilidad estructural y térmica, aunque redujo el rendimiento global del proteína hasta cierto punto.
¿Cuáles son las implicaciones a largo plazo de estos hallazgos? «Nuestros diseños muestran robustez frente a mutaciones drásticas, conservando altas temperaturas de fusión incluso cuando se entierran múltiples residuos cargados en el núcleo hidrofóbico o cuando el núcleo hidrofóbico se somete a ablación a alanina. diseño de novo de barriles TIM funcionales», dice el Dr. Huang.
En resumen, el nuevo diseño de plegado en barril de TIM tiene múltiples implicaciones en el campo del reconocimiento molecular y la catálisis enzimática. Debido a la frecuente aparición de estructuras de barril TIM en enzimas clave, este estudio también tiene posibles implicaciones terapéuticas.
Mas informaciones:
Alexander E. Chu et al, Diseño De Novo de un barril TIM ovoide altamente estable: desbloquear la forma de bolsillo para el diseño funcional, Investigación en biodiseño (2022). DOI: 10.34133/2022/9842315
Proporcionado por BioDesign Research
Cotizar: Los biólogos computacionales diseñan una proteína de barril de triosafosfato isomerasa nueva y mejorada (14 de diciembre de 2022) recuperado el 14 de diciembre de 2022 de https://phys.org/news/2022-12-biologists-triosefosfato-isomerase-barrel-protein.html
Este documento está sujeto a derechos de autor. Aparte de cualquier trato justo con fines de estudio o investigación privados, ninguna parte puede reproducirse sin permiso por escrito. El contenido se proporciona únicamente con fines informativos.





