Desarrollo y validación de nomogramas que predicen la supervivencia general y específica del cáncer para tumores óseos malignos primarios no metastásicos de pacientes espinales

Características del paciente
En este estudio se incluyeron un total de 1.137 pacientes y se sometieron a análisis OS y CSS, que se aleatorizaron en grupos de entrenamiento (n = 795) y validación (n = 342) (Tabla 1). Entre todos los pacientes con PMBS no metastásico, los hombres (654, 57,5%) tenían más probabilidades de ser hombres que mujeres (483, 42,5%) en términos de género, y los blancos (974, 85,7%) eran la mayoría en términos de carrera Información. En cuanto a los tipos histológicos, el condrosarcoma (394, 34,7 %) tuvo la mayor proporción, seguido del cordoma (320, 28,1 %), el sarcoma de Ewing (156, 13,7 %) y el osteosarcoma (145, 12, 8 %), que tuvieron una distribución similar , y el tumor óseo maligno de células gigantes (15, 1,3%) tuvo la proporción más baja. Entre los tamaños de tumor, 50-129 mm (659, 58,0%) fue el más común. El Regional (671, 59,0%) es superior al Localizado (466, 41,0%) en la etapa histórica. La mayoría de los pacientes fueron intervenidos quirúrgicamente (825, 72,6%) y solo unos pocos optaron por radioterapia (406, 35,7%) o quimioterapia (352, 31,0%). La diferencia entre los grupos de entrenamiento y validación no fue estadísticamente significativa (P > 0,05).
Detección de nomograma variable
Para obtener la mejor combinación de variables, utilizamos los modelos de regresión de Cox, Best-subset y Lasso para realizar un análisis de regresión multivariado paso a paso sobre las características clínicas en el grupo de entrenamiento. Luego usamos los valores de AUC para comparar los tres modelos con tasas de supervivencia de OS y CSS de 1 año, 3 años, 5 años y 10 años y encontramos que el modelo seguido por Cox superó a todos los demás en cada situación (Fig. . . S1). Mediante la regresión de Cox multivariante paso a paso, los valores de AUC para la SG de 1 año, 3 años, 5 años y 10 años fueron 0,809 (IC del 95 % = 0,749–0,869), 0,799 (IC del 95 % = 0,744–0,854) , 0,790 (IC 95 % = 0,741–0,838) y 0,779 (IC 95 % = 0,720–0,837), y para 1 año, 3 años, 5 años y 10 años CSS fue 0,831 (IC 95 % = 0,760 –0,902), 0,856 (IC 95 % = 0,792–0,921), 0,842 (IC 95 % = 0,790–0,903) y 0,822 (IC 95 % = 0,756–0,888), respectivamente.
Finalmente, la edad, la raza, el estadio histórico, la histología, el tamaño del tumor, el grado, la cirugía y la cirugía combinada con radiación se identificaron como factores pronósticos independientes para la SG (Fig. 1a). La edad, el estadio histórico, la histología, el tamaño del tumor, el grado y la cirugía se determinaron como factores pronósticos separados para el CSS (Fig. 1b). Realizamos un análisis de supervivencia Kaplan‒Meier de la población general basado en factores de riesgo de pronóstico separados para OS (Fig. S2) y CSS (Fig. S3). Los resultados revelaron que la edad < 30 años (P < 0,001), otras razas (P = 0,035), Grado I y II (P < 0,001), cordoma (P < 0,001), etapa localizada (P < 0,001), tamaño del tumor < 50 mm (P < 0,001), cirugía (P < 0,001) y cirugía combinada con radiación (P = 0,005) tuvieron mejor SG y edad < 30 años (P < 0,001), Grado I y II (P < 0,001), cordoma y gigante el tumor óseo maligno de células (P < 0,001), el estadio localizado (P < 0,001), el tamaño del tumor < 50 mm (P < 0,001) y la cirugía (P < 0,001) tuvieron mejor CSS.
Diagrama de bosque que representa el efecto de diferentes factores pronósticos en la supervivencia general (SG) (El) y supervivencia cáncer específica (CSS) (B).
Construcción y validación del nomograma
Construimos nomogramas del grupo de entrenamiento en pacientes con PMBS no metastásico en función de las variables evaluadas para predecir la SG y la CSS al año, 3 años, 5 años y 10 años en pacientes con PMBS no metastásico (Fig. 2). El valor del índice C fue 0,753 (95 % IC = 0,726–0,780, P <0,001) para OS y 0,812 (95 % IC = 0,782–0,841, P <0,001) para CSS. Podemos calcular la puntuación total del paciente para evaluar las tasas de supervivencia, por ejemplo, un paciente blanco de 65 años con osteosarcoma regional y un tumor de grado II, tamaño 65 mm, que se sometió a cirugía únicamente. En consecuencia, la probabilidad de SG a 1 año, 3 años, 5 años y 10 años es 0,920 (IC 95 % = 0,870–0,960), 0,730 (IC 95 % = 0,620–0,870), 0,650 (IC 95 % = 0,510–0,820 ) y 0,460 (IC del 95 % = 0,303–0,710), la probabilidad de CSS a 1 año, 3 años, 5 años y 10 años es 0,950 (IC del 95 % = 0,920–0,990), 0,850 (IC del 95 % = 0,750–0,960) , 0,810 (IC 95 % = 0,690–0,950) y 0,710 (IC 95 % = 0,550–0,920), respectivamente.
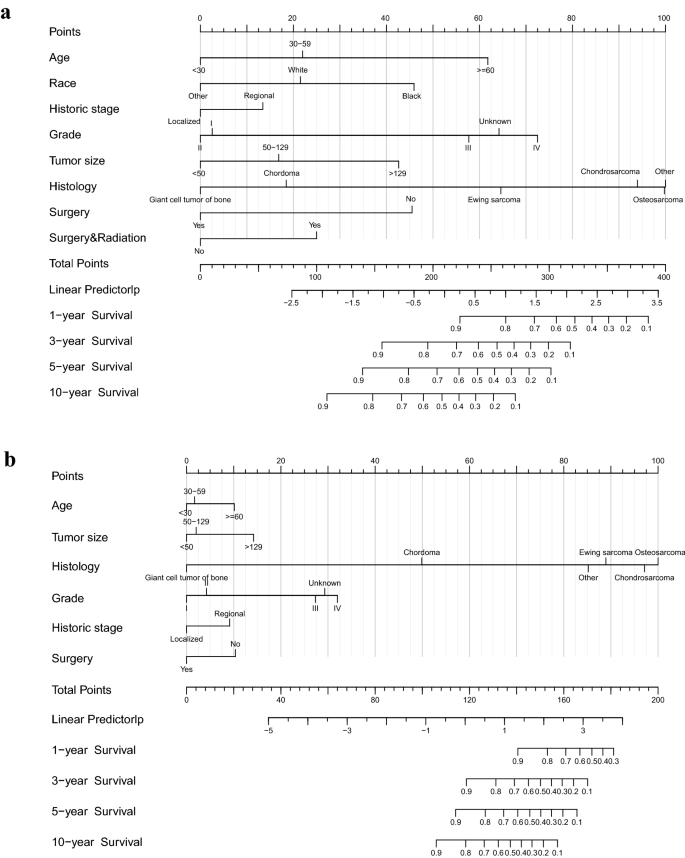
Los nomogramas pronósticos para OS (El) y CSS (B).
Usamos el grupo de prueba para validar el nomograma. En el grupo de prueba, las AUC de los modelos que predicen la SG a 1, 3, 5 y 10 años (Fig. S4) fueron 0,857 (IC del 95 % = 0,799–0,915), 0,857 (IC del 95 % = 0,779–0,936), 0,837 (IC 95 % = 0,763–0,911) y 0,814 (IC 95 % = 0,744–0,885). En el CSS, las AUC de 1 año, 3 años, 5 años y 10 años (Fig. S4) fueron 0,871 (IC del 95 % = 0,789–0,952), 0,877 (IC del 95 % = 0,781–0,974), 0,865 (IC 95 % = 0,776–0,954) y 0,853 (IC 95 % = 0,762–0,944), respectivamente. Los resultados muestran que ambos modelos funcionan bien en la predicción de OS y CSS, con valores de AUC > 0,814 en todos los grupos de prueba, ya sea OS o CSS, lo que indica una buena discriminación de los nomogramas. Las curvas de calibración para los nomogramas mostraron un alto grado de concordancia, en los grupos de entrenamiento y validación, entre las probabilidades de supervivencia observadas y previstas (Fig. S5). Estudiamos y validamos simultáneamente el valor clínico del nomograma. Al comparar los beneficios clínicos de nuestros modelos con el grupo de validación, las curvas DCA mostraron que la utilidad clínica de OS basada en el nomograma (Fig. S6) y CSS (Fig. S7) al año, 3 años, 5 años y 10 años fue casi idénticas a las observaciones reales en ambos grupos. En la curva DCA, el eje Y mide el beneficio neto y el eje X es el umbral de probabilidad de necesitar intervención13.14. El área bajo la curva indica la utilidad clínica del modelo, y cuanto más lejos esté la curva del modelo de la línea ‘sin tratamiento’ o ‘todo el tratamiento’, mejor será el valor clínico. Nuestros modelos para OS (rango: 0,09–0,741) y CSS (rango: 0,075–0,580) tienen valor clínico dentro de un rango de probabilidad de umbral específico en comparación con los dos casos extremos. En conclusión, el nomograma PMBS no metastásico tiene un poder discriminativo y de calibración considerable y muestra beneficios clínicos consistentes con lo observado, lo que implica que tiene mejores implicaciones para la implementación clínica.
Calculadora de tasa de supervivencia basada en web
Para usar el nomograma de manera más intuitiva para la formulación de políticas clínicas, además configuramos dos calculadoras de supervivencia basadas en red para calcular el OS (https://rocksyy.shinyapps.io/OSDynNomapp/) y CSS (https://rocksyy.shinyapps.io/CSSDynNomapp/) en pacientes con PMBS no metastásico (fig. 3). Simplemente ingrese la información del paciente correspondiente en el lado izquierdo de la superficie de la red para informar la curva de supervivencia y evaluar la probabilidad de supervivencia.
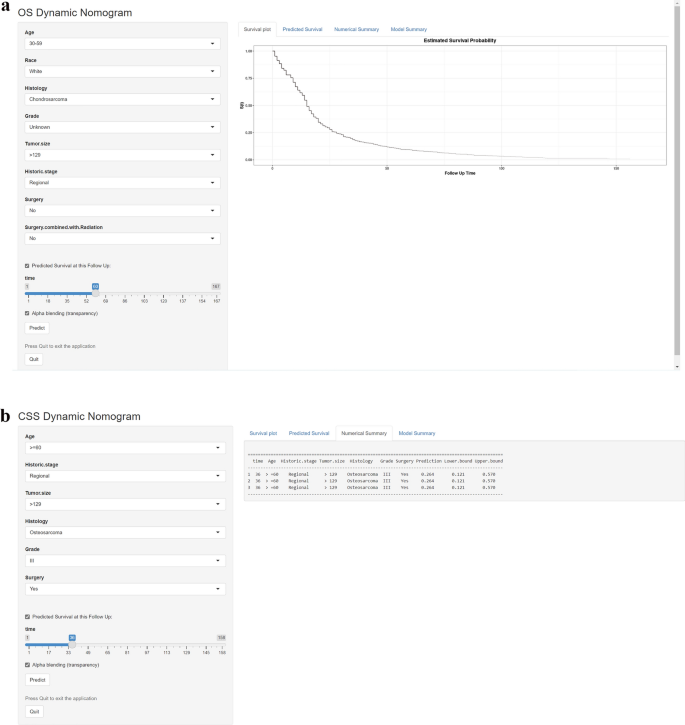
Calculadora de tasa de supervivencia basada en la web utilizada para predecir la SG de pacientes con PMBS no metastásico (El) y CSS (B).
Análisis de supervivencia por estratificación de riesgo
Además, calculamos una puntuación de riesgo para cada paciente con PMBS no metastásico en la población general según un modelo de nomograma. Dividimos a los pacientes inscritos en tres subgrupos de riesgo según el valor de corte óptimo proporcionado por el software X-tile. Los grupos de riesgo de SG incluyeron el grupo de bajo riesgo (n = 631, puntuación 12,52-178,16 puntos), grupo de riesgo intermedio (n = 389, puntuación 178,68-259,49 puntos) y alto riesgo (n = 117, puntuación 260,41-369,52 puntos). Los grupos de riesgo para CSS incluyeron el grupo de bajo riesgo (n = 590, puntuación de 37,85 a 122,23 puntos), grupo de riesgo intermedio (n = 417, puntuación de 122,32 a 149,78 puntos) y alto riesgo (n = 130, puntuación de 149,92 a 179,78 puntos) ). Realizamos análisis de supervivencia para los tres subgrupos utilizando el método de Kaplan‒Meier, y cada subgrupo de riesgo representó un pronóstico diferente (Fig. 4). Los resultados revelaron que tanto OS (P < 0,001) como CSS (P < 0,001) en los tres subgrupos estaban separados con precisión. El pronóstico de los pacientes con puntajes de bajo riesgo fue mejor que aquellos con puntajes de alto riesgo, lo que refleja que la estratificación de riesgo construida con base en el nomograma tiene valor predictivo disponible para el pronóstico de los pacientes con PMBS no metastásico.
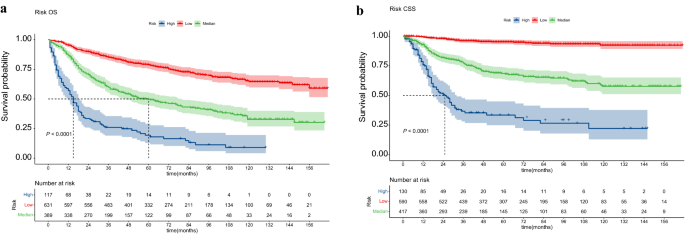
Análisis de subgrupos de riesgo de OS (El) y CSS (B) utilizando el método Kaplan‒Meier.


/cloudfront-ap-southeast-2.images.arcpublishing.com/nzme/ZNUPAFFJQWWAEQB2AT7IH463B4.jpg)


